介绍
核心实验室在提供与广泛的客户、样本类型和测序方法相关的各种下一代测序(NGS) 服务时,必须平衡好其 NGS 工作流程的效率与他们生成的数据的质量。随着测序成本的下降,与文库制备相关的费用开始成为整个 NGS 工作流程成本的大头。为了解决测序中的这一主要费用问题,许多机构跟随了反应小型化的趋势,有效地将反应体积减少到制造商推荐体积的 10%。
本应用说明重点介绍了即使在低细胞输入的情况下也能通过精确的正排量微流控试剂分配生成高质量 NGS 文库的工作流程。四分之一体积的 Illumina Nextera XT 文库制备的质量控制数据展示了反应小型化在单细胞测序背景下的适用性和有效性。
材料:
- Eppendorf twin.tec 384 板 (PN 0030129342)
- Illumina Nextera XT DNA 文库制备试剂盒 (PN FC-131-1096)
- Illumina Nextera XT 索引试剂盒 V2 (FC-131-2001)
- 热循环仪
- FORMULATRIX® MANTIS® 液体处理器 (PN MANTV3.2)
- Alpaqua 384 柱式磁板 (PN A001222)
- ThermoFisher Qubit 4 荧光计 (PN Q33226)
- Agilent 2100 Bioanalyzer (PN G2939BA)
方法
四分之一体积的 Illumina Nextera XT 文库制备
在该试点项目中使用了 8 个小鼠神经元细胞 cDNA 样本(3 种细胞类型;1 ng 的input DNA ),然后通过以下实验方案评估以四分之一体积产生的文库的质量:
**A. Tagment cDNA – 总反应体积为6.35 µL **
在 384 孔微孔板的孔中加入 1.25 µL input DNA。
将 TD 缓冲液吸入 200 µL 移液器吸头*,并置于 MANTIS 的 LV 芯片上。将 2.5μL 的 TD 缓冲液分配到MANTIS微孔板上含有样品的每个孔中。
混合。
将 ATM 吸到 200 µL 移液器吸头*中,然后置于 MANTIS 的 LV 芯片上。将 1.3μL 的 ATM 分配到MANTIS微孔板上含有样品的每个孔中。
混合。
热循环:
i. 55℃下保持5 分钟
ii. 之后一直保持10℃
将 NT 缓冲液吸入 200 µL 移液器吸头*,并置于 MANTIS 的 LV 芯片上。将 1.3µL 的 NT 缓冲液分配到MANTIS微孔板上含有样品的每个孔中。
混合。
室温培养 5 分钟。
B. 文库扩增– 12.65 µL 总反应体积
将 NPM 吸入 200 µL 移液器吸头*,并置于 MANTIS 的 LV 芯片上。将 3.8 µL 分配到MANTIS微孔板上含有样品的每个孔中。
手动移取 1.25 µL 两种index primer置于样品中,以便每个样品获得独特的index primer组合。
混合。
热循环:
i. 72℃下3分钟
ii. 95℃ 下30秒
iii. 以下做12 次循环
a. 95℃下 10 秒
b. 55℃ 下 30 秒
c. 72℃ 下 30 秒
iv. 72℃下5 分钟
v. 一直保持10℃
C. 文库清理
1.将 AMpure XP 微珠吸入 200 µL 移液器吸头*,然后置于 MANTIS 的 HV 芯片上。将10 µL 分配到MANTIS微孔板上含有样品的每个孔中。
2.混合。
3.室温培养5分钟
4.将微孔板放在磁上,等待 2 分钟
5.手动去除所有上清液(在第 11 步之前不要从磁上取下微孔板)
6.在 MANTIS 上使用持续流功能选项,将 50 µL 80% EtOH 添加到微孔板上含有样品的每个孔中。
7.培养30秒。
8.手动去除所有上清液,同时将微孔板置于磁上。
9.重复步骤 6-8。 1. 风干 15 分钟。 2. 从磁上取下微孔板。 3. 将 RSB 吸到 200 µL 移液器吸头*中,然后放在 MANTIS 上的 HV 芯片上。 4. 分配15 µL至MANTIS微孔板上含有样品的每个孔中。 5. 混合。 6. 在室温下培养 2 分钟。 7. 将微孔板放在磁上。 8. 培养 2 分钟。 9. 手动将 12.5 µL 从微珠转移到新微孔板上。
D. 吸入量 = 每个样品的分配量 x 样品数量 + 10% 安全系数。 当吸入量大于 200 µL 时,请使用 1000 µL 移液器吸头。
结果:
通过 Agilent BioAnalyzer 的追踪评估每个样品的 Nextera 文库质量。
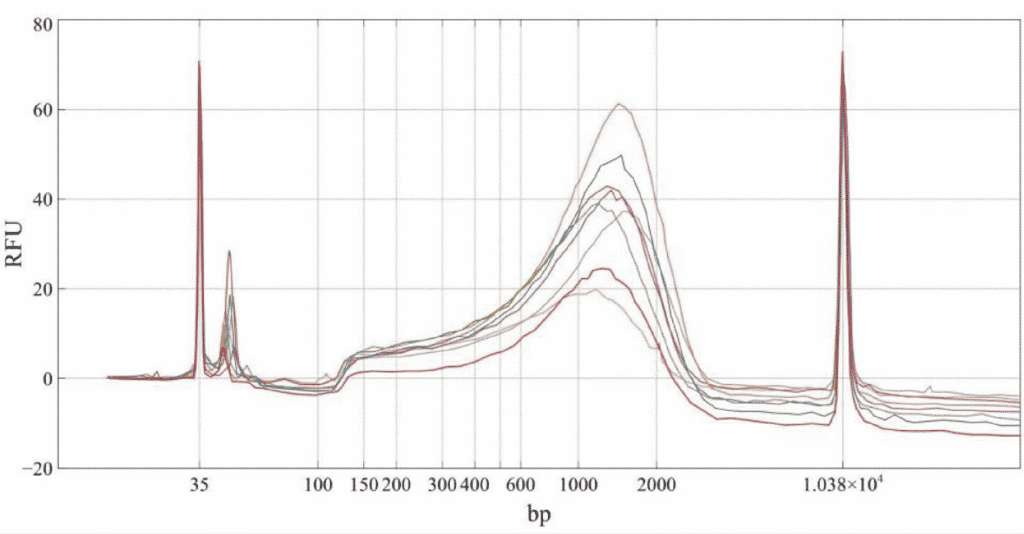
图 1. 从 8 个独特的 1ng 鼠神经元细胞 cDNA 样本制备的 8 个下一代测序文库的 Bio nalyzer 追踪
总结:
根据BioAnalyzer 数据追踪,通过四分之一体积反应小型化制备的文库组成是可以接受的,并且与按照全体积实验方案制备的文库组成相当。
以四分之一体积制备文库可显著节省每次反应试剂盒成本的 75%。 FORMULATRIX® 的MANTIS® 液体处理器通过以低至 100 nL 的体积进行精确的微流控试剂分配,促进反应小型化,并且无耗材、使用简单且可靠。
来源:@波士顿富默乐
时间:2022年02月10日
