Presentación
Los laboratorios centrales deben equilibrar la eficiencia de sus flujos de trabajo de NGS con la calidad de los datos que generan al proporcionar una variedad de servicios de secuenciación de próxima generación (NGS) relacionados con una amplia gama de clientes, tipos de muestras y métodos de secuenciación. A medida que disminuye el coste de la secuenciación, los costes asociados a la preparación de bibliotecas están empezando a convertirse en una parte importante de los costes generales del flujo de trabajo de NGS. Para hacer frente a este importante problema de costes en la secuenciación, muchas instituciones han seguido la tendencia hacia la miniaturización de las reacciones, reduciendo de hecho los volúmenes de reacción al volumen recomendado por el fabricante de 10%.
Esta nota de aplicación destaca el flujo de trabajo para generar bibliotecas NGS de alta calidad mediante la dispensación precisa de reactivos microfluídicos de desplazamiento positivo, incluso en presencia de un bajo aporte celular. Los datos de control de calidad de una preparación de bibliotecas Illumina Nextera XT de un cuarto de volumen demuestran la aplicabilidad y la eficacia de la miniaturización de la reacción en el contexto de la secuenciación unicelular.
Materiales.
- Placa Eppendorf twin.tec 384 (PN 0030129342)
- Kit de preparación de bibliotecas de ADN Illumina Nextera XT (PN FC-131-1096)
- Kit de indexación Illumina Nextera XT V2 (FC-131-2001)
- Termociclador
- Procesador de líquidos FORMULATRIX® MANTIS® (PN MANTV3.2)
- Alpaqua 384 Columna Placa Magnética (PN A001222)
- Fluorómetro ThermoFisher Qubit 4 (PN Q33226)
- Bioanalizador Agilent 2100 (PN G2939BA)
Métodos
Preparación de bibliotecas Illumina Nextera XT de un cuarto de volumen
En este proyecto piloto se utilizaron ocho muestras de ADNc de células neuronales de ratón (3 tipos celulares; 1 ng de ADN de entrada), y a continuación se evaluó la calidad de la biblioteca generada en un cuarto de volumen mediante el siguiente protocolo experimental:
**A. Tagment cDNA - volumen total de reacción de 6,35 µL **
Añada 1,25 µl de ADN de entrada a los pocillos de una placa de microtitulación de 384 pocillos.
El tampón TD se pipetea en una punta de pipeta de 200 µl* y se coloca en el chip LV del MANTIS. Dispense 2,5 µl de tampón TD en cada pocillo que contenga una muestra en la microplaca MANTIS.
Mezcla.
Se pipetea ATM en una punta de pipeta de 200 µL* y se coloca en el chip LV del MANTIS. Dispensar 1,3 µl de ATM en cada pocillo de la microplaca MANTIS que contiene la muestra.
Mezcla.
Ciclo térmico.
i. 5 minutos a 55°C
ii. tras lo cual se conserva a 10°C
El tampón NT se pipetea en una punta de pipeta de 200 µl* y se coloca en el chip LV del MANTIS. Dispense 1,3 µl de tampón NT en cada pocillo que contenga una muestra en la microplaca MANTIS.
Mezcla.
Incubar a temperatura ambiente durante 5 minutos.
B. Amplificación de la biblioteca - 12,65 µl de volumen total de reacción
Pipetear el MNP en una punta de pipeta de 200 µl* y colocarla en el chip LV del MANTIS. Dispense 3,8 µl en cada pocillo que contenga una muestra en la microplaca MANTIS.
Se pipetearon manualmente 1,25 µl de ambos cebadores índice en las muestras para obtener una combinación única de cebadores índice para cada muestra.
Mezcla.
Ciclo térmico.
i. 3 minutos a 72°C
ii. 30 segundos a 95°C
iii. realizar los 12 ciclos siguientes
a. 10 segundos a 95°C
b. 30 segundos a 55°C
c. 30 segundos a 72°C
iv. 5 minutos a 72°C
v. 10°C en todo momento
C. Limpieza de la biblioteca
1. Extraer las microesferas AMpure XP en una punta de pipeta de 200 µL* y colocar en el chip HV del MANTIS. 2. Dispensar 10 µL en cada pocillo de la microplaca MANTIS que contiene la muestra.
2. Mezcla.
3. Incubar a temperatura ambiente durante 5 minutos
4. Colocar la microplaca sobre el imán y esperar 2 minutos
5. Eliminar todo el sobrenadante manualmente (no retirar la microplaca del imán hasta el paso 11).
6. Utilizando la opción de función de flujo continuo del MANTIS, añada 50 µl de 80% EtOH a cada pocillo que contenga la muestra en la microplaca.
7. Incubar durante 30 segundos.
8. Eliminar manualmente todo el sobrenadante mientras se coloca la placa de microtitulación en el imán.
9. Repita los pasos 6-8. 1. Deje secar al aire durante 15 minutos. 2. Retire la microplaca del imán. 3. Pipetear el RSB en una punta de pipeta de 200 µL* y colocar en el chip HV del MANTIS. 4. Dispensar 15 µL en cada pocillo de la microplaca MANTIS que contiene la muestra. 5. Mezclar. 6. Incubar a temperatura ambiente durante 2 minutos. 7. Colocar la microplaca sobre el MANTIS. 7. Colocar la microplaca sobre el imán. 8. Colocar la microplaca sobre el imán. 8. Incubar durante 2 minutos. 9. Cerrar la microplaca. 9. Transferir manualmente 12,5 µl de las microesferas a la nueva microplaca.
D. Volumen de aspiración = volumen dispensado por muestra x número de muestras + factor de seguridad 10%. Para volúmenes de aspiración superiores a 200 µl, utilice una punta de pipeta de 1000 µl.
Resultados.
La calidad de la biblioteca Nextera se evaluó para cada muestra mediante rastreo con el Agilent BioAnalyzer.
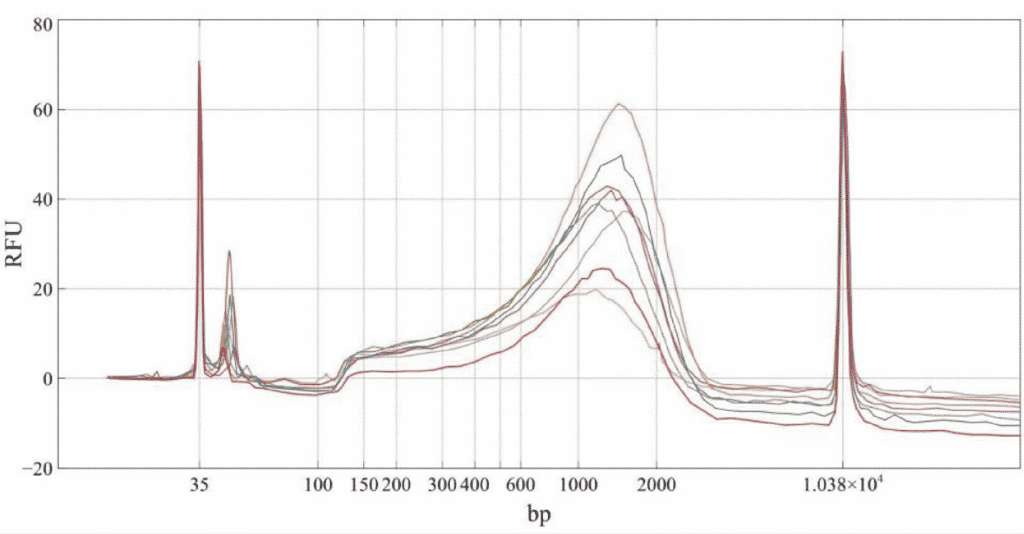
Figura 1. Trazado Bio nalyzer de 8 bibliotecas de secuenciación de nueva generación preparadas a partir de 8 muestras únicas de ADNc de células neuronales murinas de 1ng.
Resumen.
Según el trazado de datos del BioAnalyzer, la composición de la biblioteca preparada mediante la miniaturización de la reacción en un cuarto de volumen es aceptable y comparable a la preparada según el protocolo experimental de volumen completo.
El procesador de líquidos MANTIS® de FORMULATRIX® facilita la miniaturización de las reacciones mediante la dosificación microfluídica precisa de reactivos en volúmenes tan bajos como 100 nL, y su uso es sencillo, fiable y sin consumibles.
Fuente: @BostonFummerle
Fecha: 10 de febrero de 2022
