ECCS B310/B320 Sistema confocal para la visualización de reacciones electroquímicas
Japón Lasertec Corporation Batería eléctrica
Con el desarrollo de dispositivos de almacenamiento de energía de nueva generación, las baterías de iones de litio para alimentar dispositivos móviles y vehículos eléctricos, es probable que aumente su demanda. Sin embargo, el litio es caro porque no es un metal abundante. El sodio, en cambio, es abundante y barato, y el interés por las baterías de iones de sodio (SIB) ha ido en aumento. Se han investigado diversos materiales para utilizarlos como cátodos o ánodos de las SIB. La mayoría de estos estudios se han llevado a cabo en sistemas de media celda que contienen un electrodo de trabajo (WE), un contraelectrodo (CE) y, si es necesario, un electrodo de referencia (RE). El WE contiene material catódico o anódico. Es concebible utilizar sodio como material de electrodo negativo, pero esto sería difícil en la práctica por cuestiones de seguridad.
Existen muchos informes sobre la deposición/disolución electroquímica del litio. Los electrodos de litio metálico tienen el inconveniente de que se cortocircuitan y de que el rendimiento de los ciclos es deficiente debido a la formación de "dendritas" de litio durante la deposición electroquímica. La deposición electroquímica de litio en una solución electrolítica de LiAsF2/etileno-carbonato-2-metiltetrahidrofurano de 0,5 mA/cm2, tal como se describe en las referencias, procede como sigue. El litio crece desde la parte inferior del electrodo de litio y produce un retorcimiento. Como resultado, la forma del litio precipitado se vuelve dendrítica. A continuación, el litio comienza a depositarse en las puntas de las dendritas de litio y en los puntos de acodamiento. La forma del litio depositado es granular. La disolución electroquímica de las dendritas de litio procede del siguiente modo. Se disuelven las partículas de litio de la punta y del punto de inflexión. A continuación, la matriz de la dendrita se disuelve y la dendrita se convierte en "litio muerto". Esta es una de las razones de la escasa reversibilidad de los electrodos de litio metálico. Además, los estudios sobre la forma del litio depositado electroquímicamente en diversos electrolitos han demostrado que la forma depende del electrolito.
Como ya se ha mencionado, existen numerosos informes sobre la deposición/disolución electroquímica de litio. Sin embargo, hay pocos informes sobre la deposición/disolución electroquímica de sodio. Es importante comprender el comportamiento (por ejemplo, los cambios de forma durante el ciclo, la reversibilidad y la eficiencia coulómbica) para facilitar el desarrollo de SIB. En este estudio, nos centramos en el sodio metálico como CE y observamos el cambio de forma del sodio depositado/disuelto electroquímicamente en una solución electrolítica basada en carbonato de propileno (PC). Las soluciones basadas en PC se utilizan ampliamente como electrolitos para SIBs y el uso de un único disolvente nos permitió dilucidar el comportamiento de deposición/disolución. Se utilizaron electrodos de sodio y cobre como WE, y electrodos de sodio como CE como sistema de reacción típico. Para la observación, se utilizó un microscopio óptico, tal y como se informó en nuestros estudios anteriores sobre materiales de ánodo de Sn-Co. Esta técnica nos permitió observar la sección transversal de la superficie del electrodo de sodio durante la deposición/disolución electroquímica de sodio y grabar vídeos del crecimiento de sodio para su observación in situ. Además, para investigar la presencia de capas finas superficiales como las interfaces electrolíticas sólidas (SEI) sobre el sodio depositado, por ejemplo Li2CO3 y Li2O sobre el litio depositado, examinamos la composición superficial del sodio depositado utilizando un microscopio electrónico de barrido (SEM) equipado.Propiedades como la conductividad iónica de las SEI son importantes para conseguir una buena reciclabilidad.
En este estudio, el comportamiento electroquímico de deposición/disolución de sodio en una solución electrolítica basada en carbonato de propileno se investigó principalmente mediante microscopía óptica in situ. En primer lugar, se depositó sodio granular en las fosas del electrodo de sodio durante el proceso catódico. A continuación, las partículas de sodio crecieron linealmente desde la superficie del electrodo en forma de aguja. En el proceso anódico posterior, el sodio se disuelve cerca de la raíz de las agujas del electrodo de sodio y el denominado "sodio muerto" se desprende del electrodo. El mecanismo de deposición y disolución electroquímica de sodio en electrodos de cobre es similar al de los electrodos de sodio.

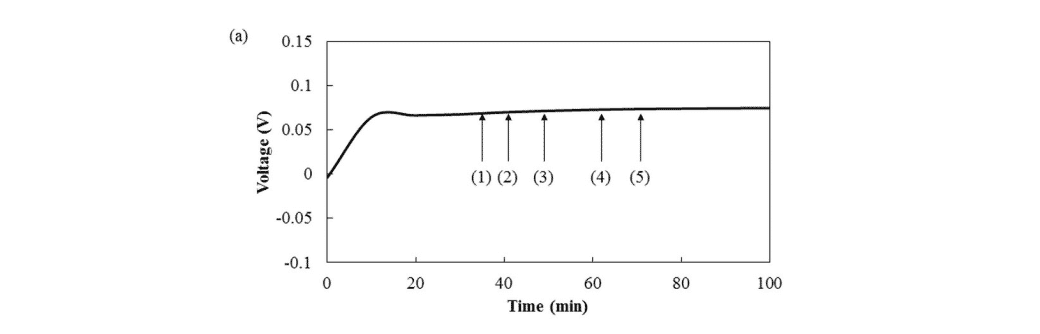


La imagen 3 muestra la observación directa de los cambios morfológicos en los electrodos de sodio o cobre durante la deposición/disolución electroquímica mediante el uso de un microscopio óptico in situ (Lasertec Corp., ECCS B310) de la misma manera que se informó anteriormente. Las unidades circulares para la observación microscópica se prepararon apilando láminas de sodio (0,2 mm de grosor y 15 mm de diámetro, Kanto Chemical Corp.) o láminas de cobre (0,01 mm de grosor y 15 mm de diámetro) como WE, electrolitos para preparar soluciones (1 M NaPF6/PC, Tomiyama Pure Chemicals Industries Ltd.), diafragma de polipropileno impregnado (19 mm de diámetro, Celgard) y copos de sodio como CE. Como se muestra en la Fig. suplementaria 3(a), la célula circular se cortó en semicírculos y se preparó una sección transversal expuesta de la WE/diafragma con solución electrolítica/CE de la célula para su observación. A continuación, se colocó la célula semicircular en un soporte para microscopía óptica y se observó la sección transversal de la superficie utilizando un microscopio óptico a través de una ventana de visualización hecha de zafiro, como se muestra en la Fig. suplementaria 3(b). Las mediciones electroquímicas se llevaron a cabo utilizando un sistema automático de descarga-carga de corriente constante (Hokuto Denko Corp., HJ1001SD8) a una corriente constante de 50 μA (57 μA/cm2) a temperatura ambiente.
Autores: YuhkiYui, Masahiko Hayashi & Jiro Nakamura
Institución: NTT Device Technology Labs., NTT Corporation 3-1, Morinosato Wakamiya, Atsugi-shi, Kanagawa Pref. 243-0198, Japón; Department of Electronic Chemistry, Interdisciplinary Graduate School of Science and Engineering, Tokyo Institute of Technology, 4259 Nagatsuta, Midori-ku, Yokohama 226-0198, Japón. Chemistry, Interdisciplinary Graduate School of Science and Engineering, Tokyo Institute of Technology, 4259 Nagatsuta, Midori-ku, Yokohama 226- 8502, Japón.
Publicado: recibido: 24 de septiembre de 2015; aceptado: 12 de febrero de 2016; publicado: 01 de marzo de 2016.
Revista: The nature scientificreports
Sitio web fuente del artículo.Observación microscópica in situ de la deposición/disolución de sodio en el electrodo de sodio
Japón Lasertec Corporation Batería eléctrica